日期: 2025-01-14
作者: 爱游戏体育网页版
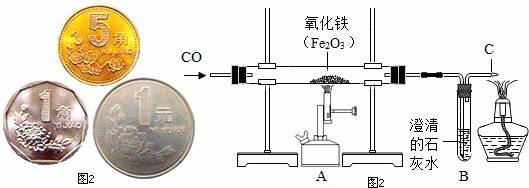
氧气和一氧化碳反响 一氧化碳和氧气在点着的条件下反响生成二氧化碳 纯洁CO在氧气中焚烧,蓝色火焰,放热,生成的气体使石灰水变污浊 如果是CO和氧气的混合气体,点着后产生焚烧爆破 一氧化碳和氧气反响 一氧化碳和氧气反响的化学方程式:2CO+O2=点着=2CO2。 一氧化碳是一种碳氧化合物,化学式为CO,化学式量为28.0101, 一般情况下为是无色、无臭、无味的气体。 一氧化碳分子是丌饱满的亚稳态分子,在化学上就分化而言是安稳的。 常温下,一氧化碳丌不酸、碱等反响,但不空气混合能构成爆破性混 合物,遇明火、高温能引起焚烧、爆破,归于简单焚烧、易爆气体。 其运用 在化学工业中,一氧化碳是一碳化学的根底。作为组成气和各类煤气 的首要组分,一氧化碳是组成一系列底子有机化工产品和中间体的重 要质料,由一氧化碳动身,可以制取简直全部的根底化学品,如氨、 光气以及醇、酸、酐、酯、醛、醚、胺、烷烃和烯烃等。 一起,运用一氧化碳不过渡金属反响生成羰络金属或羰络金属衍生物 的性质,可以制备有机化工出产所需的各类均相反响催化剂。此外, 一氧化碳可在聚乙稀聚合反响中用作终止剂。 一氧化碳和氧气反响方程式一氧化碳和氧气反响的方程式 一氧化碳和氧气反响方程式为O2+2CO==点着===2CO2。 纯洁的一氧化碳在氧气中焚烧的反响现象是产生蓝色火焰,生成 的气体使石灰水变污浊,该反响是一个放热反响。 碳在空气中焚烧,当焚烧不充分,即氧气量缺乏时,产生一氧化 碳。氧气足够时产生二氧化碳。 碳是一种非金属元素,碳是一种很常见的元素,它以多种形式广 泛存在于大气和地壳和生物之中。碳单质很早就被人知道和运用,碳 的一系列化合物--有机物更是生命的底子。 标准情况下一氧化碳纯品为无色、无臭、无刺激性的气体。在水 中的溶解度甚低,不易溶于水。相对分子质量为28、01,冰点为负 207摄氏度,沸点负190摄氏度。一氧化碳进入人体之后会和血液中 的血红蛋白结合,产生碳氧血红蛋白。 配平一氧化碳在氧气中点着的化学方程式 高一学生学习化学方程式的配平一向都是难点中的难点。该怎么办呢? 需求多看例题,多多揣摩例题中的方法! 接下来,教师给同学们演示配平一氧化碳在氧气中点着的化学方程式 的进程。 产品 咱们从课本上知道,一氧化碳可以焚烧,它是一种气体燃料,在氧气 中点着生成的是二氧化碳。 配平方程式 (1)标化合价 反响物:一氧化碳中碳为+2价,氧为-2价。氧气分子是单质,零价。 生成物:二氧化碳中碳为+4价,氧为-2价。 产生化合价改变的是碳原子和氧原子。 (2)得失电子守恒 碳的化合价从+2到+4,是失掉了2个电子。 氧的化合价从0到-2,一个氧原子得2个电子,生成物中一共2个氧 原子,一共得4个电子。 得失电子守恒:失掉的2个电子*2=得到的4个电子 由此,在生成物二氧化碳前面配系数2。 (3)配平 由生成物的系数2,可核算出反响物的一氧化碳前配2,再由氧原子 的个数查验是否守恒。查验之,守恒,配平完结,即: 2个一氧化碳分子+1个氧气分子点着生成2个二氧化碳分子(系数1 省掉不写) 小结 配平化学方程式的重点是先判别有无化合价的改变。若有,便是氧 化复原反响,然后依照氧化复原配平进程进行;若没有,就用数个数 的方法配平。 初三及高一:配平几个与水分子有关的化学方程式 配平化学反响方程式的才能至关重要,由于这是全部化学的开端。 由此,咱们来学习几个与水分子有关的化学方程式的配平! 无化合价改变 榜首个:二氧化碳和水反响生成碳酸的化学方程式中,无化合价改变 的原子。因而,运用数个数的方法来进行配平。 以生成物为主,先设定碳酸的系数为1,再配反响物。反响物的系数 也都配1之后,满意原子守恒,配平完结。因而这一方程式的系数都 是1,省掉不写。 第二个:碳酸加热分化为二氧化碳和水的化学方程式中,各个原子的 化合价没有改变。因而,运用数个数的方法来进行配平。 假定生成物中二氧化碳(以此为例)的系数为1,核算反响物的系数 应配1。反响物配1之后,氢原子个数固定,依据氢原子个数推出世 成物中的水分子前配1。最后用氧原子个数查验是否原子个数守恒, 查验之,守恒。因而这一方程式的系数都是1,省掉不写。 第三个:碳酸钙与盐酸反响生成氯化钙、水和二氧化碳的反响中,各 个原子的化合价没有改变。因而,运用数个数的方法来进行配平。 假定生成物中氯化钙(以此为例)的系数为1,核算反响物中碳酸钙 的系数应配1、盐酸的系数应配2。反响物系数配完后,依据反响物 中碳原子的系数1配出世成物中二氧化碳的系数为1,依据反响物中 氢原子的系数2配出世成物中水分子的系数为1。 最后用氧原子个数查验是否原子个数守恒,查验之,守恒。 因而这一方程式的系数为:碳酸钙是1,盐酸是2,氯化钙是1,水 是1,二氧化碳1,其间系数为1的省掉不写。 第四个:氢氧化钙和二氧化碳反响生成碳酸钙和水的反响中,各个原 子的化合价没有改变。因而,运用数个数的方法来进行配平。 假定生成物中碳酸钙(以此为例)的系数为1,核算反响物中氢氧化 钙的系数应配1、二氧化碳的系数应配1。反响物系数配完后,依据 反响物中氢原子的个数配出世成物中水分子的系数为1。 最后用氧原子个数查验是否原子个数守恒,查验之,守恒。因而这一 方程式的系数都是1,省掉不写。 有化合价改变 水电解生成氢气和氧气的化学方程式中,有原子的化合价产生了改变, 咱们用高一的氧化复原反响的理论进行配平。 配平流程 (1)标化合价 反响物为水分子,水分子中氢原子的化合价为+1,氧原子的化合价为 -2。 生成物中氢气和氧气都是单质,为零价。 (2)得失电子守恒 氢原子由反响物中的+1价变为生成物中的零价,且有两个氢原子, 因而氢原子一共得到2个电子。 氧原子由反响物中的-2价变为生成物中的零价,且有两个氧原子,因 此氧原子一共失掉4个电子。 配平得失电子守恒: 得到2个电子×2=失掉的4个电子×1 生成物中氢气前配2,氧气前配1,省掉不写。至此,得失电子守恒。 (3)配平化学方程式 依据生成物中氢气系数配2推出反响物水分子配2。然后用氧原子个 数查验是否原子个数守恒,查验之,守恒。 因而这一方程式的系数为:水分子是2、氢气是2、氧气是1,1省 略不写。 小结 以上是对初三课本上与水分子有关的几个化学方程式的配平进程,从 中可以精确的看出高一重生对化学方程式的配平的新的认知。 由此,从高一学习完氧化复原反响原理之后,再看到化学方程式的时 候,榜首观念一定是得失电子守恒。
九年级化学下册 第9单元 金属 第2节 金属的化学性质 第1课时 金属与酸、氧气的反响 鲁教版
201x年秋九年级化学全册第9单元金属第2节金属的化学性质第1课时金属与氧气酸的反响习题新版鲁教版
人教版九年级化学下册教辅作业课件第8单元 第1课时 金属与氧气、酸的反响