日期: 2024-11-12
作者: 爱游戏体育网页版
g,设备E中收集到的气体为VL(已换算成标准状况下),用上述有关丈量数据判别,SO
若SO2彻底被氧化,写出反响的化学方程式:CaO2+SO2=CaSO4.
试验二:向必定量的过氧化钠固体中通入足量SO2,取反响后的固体进行试验探求,以证明过氧化物与SO2反响的特色.
试验探求:(5)规划试验,证明假定3是正确的,扼要答复试验进程、现象和定论:取反响后的固体放入试管中,加少数的水溶解,参加氯化钡溶液有白色沉积生成,再参加稀盐酸沉积部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
剖析试验一:(1)过氧化钙和水反响,设备B中试剂能吸收水蒸气,所以试剂为浓硫酸,枯燥气体除掉水蒸气;
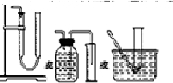
(3)试验测得设备C中过氧化钙质量添加了m1g,设备D质量添加了m2g,设备E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则产生反响:2CaO2+2SO2=2CaSO3+O2
若二氧化硫悉数被氧化产生的反响为:CaO2+SO2=CaSO4;反响进程中 无氧气生成,V=0,若0<V<$\frac{7{m}_{1}}{30}$,则二氧化硫部分被氧化;
试验二:向必定量的过氧化钠固体中通入足量的SO2,取反响后的固体进行试验探求
(5)证明假定3是正确的,试验规划为:取反响后的固体放入试管中,加少数的水溶解,参加氯化钡溶液有白色沉积生成,再参加稀盐酸沉积部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(6)试验进程中SO2的通入量直接影响探求试验成果的科学性,若剩下过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,查验出的硫酸根离子不能确认是过氧化钠和二氧化硫反响生成的;
答复解:试验一:(1)过氧化钙和水反响,设备B中试剂能吸收水蒸气,所以试剂为浓硫酸,枯燥气体除掉水蒸气,


(3)试验测得设备C中过氧化钙质量添加了m1g,设备D质量添加了m2g,设备E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则产生反响:2CaO2+2SO2=2CaSO3+O2
若二氧化硫悉数被氧化产生的反响为:CaO2+SO2=CaSO4;反响进程中 无氧气生成,V=0,若0<V<$\frac{7{m}_{1}}{30}$,则二氧化硫部分被氧化;
试验二:向必定量的过氧化钠固体中通入足量的SO2,取反响后的固体进行试验探求
(5)证明假定3是正确的,试验规划为:取反响后的固体放入试管中,加少数的水溶解,参加氯化钡溶液有白色沉积生成,再参加稀盐酸沉积部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
故答案为:取反响后的固体放入试管中,加少数的水溶解,参加氯化钡溶液有白色沉积生成,再参加稀盐酸沉积部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫;
(6)试验进程中SO2的通入量直接影响探求试验成果的科学性,若剩下过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,查验出的硫酸根离子不能确认是过氧化钠和二氧化硫反响生成的;
故答案为:若剩下过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,查验出的硫酸根离子不能确认是过氧化钠和二氧化硫反响生成的.
点评本题考察了二氧化硫性质使用和试验验证,试验规划的进程和试验计划的确认应依据题干要求剖析判别,关键是读懂题干信息,依据题干条件核算判别,标题较难.
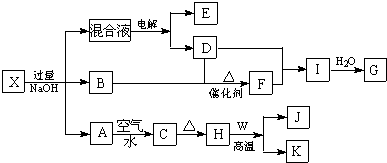
(3)对混合液电解时的阳极反响式为4OH--4e-=2H2O+O2↑.工业上金属W也可用电解法制备,电解时的阴极反响式为Al3++3e-=Al.
(4)将必定量的B和D放入容积为1L的密闭容器中,产生反响,在760~840℃下,反响到达平衡.该平衡常数的表达式为$\frac{{c}^{4}(NO){c}^{6}({H}_{2}O)}{{c}^{4}(N{H}_{3}){c}^{5}({O}_{2})}$.若平衡时两种反响物的转化率持平,则开始投料时n(B):n(D)=4:5.
(5)某恒温恒容密闭容器中,产生反响M(s)+2N(g)?P(g)+Q(g)

硅孔雀石H2SO4溶浸浸出渣硫酸铜粗液MnO2浸出液除杂滤渣滤液硫酸铜晶体…
(1)补血剂寄存时刻较长会氧化蜕变,对滤液中铁元素的存在方式提出如下假定:
(2)怎么证明进程①滤液中含有Fe2+取少数滤液参加试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(4)该小组有些同学以为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定.
②试验前,首先要准确制造必定物质的量浓度的KMnO4溶液250mL,制造时需求的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需250mL容量瓶.
③重复滴定三次,耗费1.00mol/LKMnO4标准溶液体积分别为19.98mL、20.00mL、20.02mL,3次试验所用Fe2+溶液的体积为20.00mL.请依据以上数据,再规划合理数据,完结试验进程的记载表格.
④怎么判别到达滴定结尾:滴入最终一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不康复.

(1)接通电源,通过一段时刻后,测得丙中K2SO4浓度为10.47%,乙中c电极质量添加.据此答复问题: