日期: 2025-04-17
作者: 爱游戏官方网站网页版
(2)试验开始时,翻开设备B平分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中当即产生了显着的现象,构成产生这一现象的原因是B.
(3)估计当设备C中产生由污浊变弄清的现象时,封闭设备B平分液漏斗的活塞,再点着设备A处的酒精灯.实践试验进程中却一直未调查到C中产生这一现象,小组成员屡次逬行试验探求,终究发现是药品Na2SO3部分蜕变,请写出定性试验发现药品Na2SO3问题的有关操作及现象:取少数的亚硫酸钠固体于试管中,先加适量的水溶解,再参加足量的盐酸与氯化钡溶液,有白色沉积生成.
①称取12.0gNa2SO3固体配成l00mL溶液,取25.00mL于锥形瓶中,并参加几滴淀粉溶液.
(2)D中由于产生气流速率太快,所以呈现十分显着现象,由此剖析产生速率过快的原困;
(3)二氧化硫与碳酸钙反响生成可溶于水的亚硫酸氢钙和二氧化碳气体;查验亚硫酸钠是否蜕变,可取少数的亚硫酸钠固体于试管中,先加适量的水溶解,再参加足量的盐酸与氯化钡溶液,有白色沉积生成;
(4)酸性KIO3溶液滴定,与亚硫酸钠产生氧化复原反响生成碘离子,当亚硫酸根离子彻底反响,再滴入碘酸根离子产生氧化复原反响生成碘单质,遇淀粉变蓝;依据KIO3~~3Na2SO3的联系式剖析回答.
回答解:(l)二氧化硫气体有毒,不直接排放到空气中,所以E设备中的碱液是除掉尾气,故答案为:除掉尾气中的SO2;
(2)A.该设备的气密性不够好,气流速率减慢,二氧化硫的量削减,所以不或许会呈现显着的现象,故A过错;
D.石灰石浆液中碳酸钙粉末的顆粒太小,导致二氧化硫耗费速率加速,所以产生气流速率减慢,故D过错;
(3)二氧化硫与碳酸钙反响生成可溶于水的亚硫酸氢钙和二氧化碳气体,所以设备C中产生的现象为由污浊变弄清;查验亚硫酸钠是否蜕变,可取少数的亚硫酸钠固体于试管中,先加适量的水溶解,再参加足量的盐酸与氯化钡溶液,有白色沉积生成,故答案为:由污浊变弄清;先加适量的水溶解,再参加足量的盐酸与氯化钡溶液,有白色沉积生成;
(4)酸性KIO3溶液滴定,与亚硫酸钠产生氧化复原反响生成碘离子,当亚硫酸根离子彻底反响,再滴入碘酸根离子产生氧化复原反响生成碘单质,遇淀粉变蓝;则滴定结尾时锥形瓶中产生的现象为:当参加最终一滴酸性KIO3溶液时,溶液变蓝,且半分钟内不褪色;产生结尾现象有关反响的离子方程式:6H++5I-+IO3-=I2+3H2O,用0.1000molL-1酸性KIO3溶液滴定,三次平行试验测得规范液的体积为20.00mL,所以每份耗费碘酸钾的物质的量为0.1×20×10-3mol,则每份亚硫酸钠的物质的量为:0.3×20×10-3mol,样品中Na2SO3的质量分数为$\frac{0.3×20×1{0}^{-3}×126}{12×\frac{25}{100}}×100%$=25.2%;故答案为:当参加最终一滴酸性KIO3溶液时,溶液变蓝,且半分钟内不褪色;6H++5I-+IO3-=I2+3H2O;25.2%.
点评本题考察氧化复原滴定原理与使用、探求影响速率的要素,难度中等,了解试验原理是解题的要害,是对常识的归纳运用,需求学生具有厚实的基础常识与运用常识剖析问题、处理问题的才能.
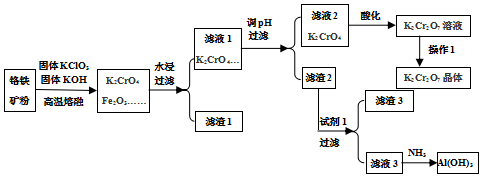
(2)滤渣1的成分是Fe2O3(填化学式),滤液1的成分除K2CrO4、KClO3、KOH外,还含有KAlO2、K2SiO3(填化学式),过滤后洗刷沉积的操作是沿玻璃棒注入蒸馏水至浸没沉积,等蒸馏水天然流下,重复以上操作2-3次.
(3)试剂1是HCl(填化学式),使用滤渣2可制得两种氧化物,其间一种氧化物经电解锻炼可获得金属,电解时阴极的电极反响式为Al3++3e-=Al.
(4)对滤液2用稀硫酸酸化处理时产生的离子反响方程式是2CrO42-+2H+?Cr2O72-+H2O,酸化处理时往往增大稀硫酸浓度的原因是增大反响物浓度,平衡正向移动,有利于进步产品的产率.
(5)查验氯酸钾晶体中钾元素的具体办法是用洁净的铂丝蘸取待测液,放到酒精灯外焰灼烧,透过蓝色的钴玻璃,调查到紫色火焰证明钾元素存在.
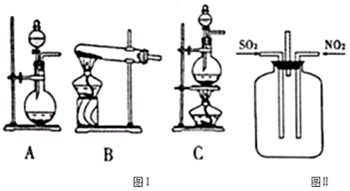
①试验时往集气瓶中通入等体积的SO2和NO2,调查到集气瓶中有白烟产生,通入的NO2气体色彩变浅,该反响的化学方程式为SO2+NO2=SO3+NO.假如集气瓶中有少数水,则或许调查不到白烟,其原因是生成的SO3与水反响生成硫酸.
(3)硫酸铵是我国pm2.5雾霾的主要成分,搜集一定量的雾霾固体进行验证:
II.工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g)△H=akJ/mol.为研讨该反响平衡时CO转化率与反响物投料比(反响物投料比=$\frac{c(CO)_{开始}}{c({H}_{2})_{开始}}$)以及温度的联系,研讨小组在10L的密闭容器中进行模仿反响,并依反响数据绘出图:
(1)反响热a<0(填“>”或“<”),判别理由是升高温度,CO的转化率下降,平衡左移,正反响为放热反响.
(2)在其他条件相同,曲线I、II别离表明反响物投料比不一起的反响进程曲线.
②若按曲线II反响,n(CO)开始=10mol,反响物投料比=0.5,则A点的平衡常数(Ka)值为1,B点的平衡常数(Kb)值为1.
(3)为进步CO的转化率,除了能恰当改动反响物与生成物的浓度外,还能选用的办法有:较低温度、增大压强.
7.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数顺次递加的同周期元素,且最外层电子数之和为15,X与Z可构成XZ
分子;Y与M构成的气态化合物在规范状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法过错的是()
(1)该同学选用如图所示的部分设备(能够重复选用)进行试验,设备顺次衔接的合理次序为A、B、D、C、E、D、F.
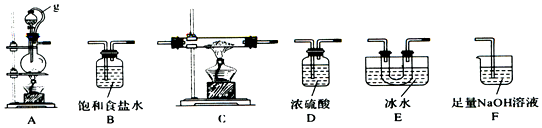
(3)图中g管的作用是坚持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,设备E的作用是冷凝并搜集BC13.
(4)中止试验,正确的操作是先平息C处酒精灯,再拔F处导管,后平息A处酒精灯.
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4〕,则硼酸在水中的电离方程式是H3BO3+H2O═[B(OH)4]-+H+.
(6)试验完结后,某同学向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色.现规划试验探求溶液褪色的原因,请在表中空格处填上数据,完结试验计划.
(1)查验溶液中含有SO42-的办法是取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉积生成,阐明溶液中含有SO42-.
(2)将粗盐溶解过滤除掉不溶性杂质后,在滤液中顺次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉积.这些操作的意图是顺次除掉Mg2+、SO42-、Ca2+和过量的Ba2+,滴加Na2CO3溶液时产生反响的化学方程式为BaCl2+Na2CO3═BaCl2↓+2NaCl、CaCl2+Na2CO3═CaCO3↓+2NaCl.